Echipa Sisteme Moleculare și Biomoleculare Complexe dezvoltă tematici CDI proprii și asigură suport de specialitate în colaborări cu alte grupuri, prin activități care vizează sinteza / caracterizarea de sisteme / materiale de interes pentru: sănătate, industria farmaceutică și a suplimentelor alimentare, materiale avansate, biotehnologii, biologie structurală, biomimetică.
Tematici iniţiate / dezvoltate
- Studii privind legarea competitivă a medicamentelor de proteine plasmatice
- Îmbunătățirea solubilității și biodisponibilității substanțelor bioactive de sinteză și naturale prin optimizarea formei solide și încapsulare moleculară
- Studii de stabilitate a compușilor bioactivi la interacțiunea cu excipienții și la acțiunea factorilor de mediu
- Biologie structurală: determinarea de structuri proteice prin crio-microscopie electronică, inițierea de activități de marcare izotopică a proteinelor și investigații structurale și de dinamică moleculară prin spectroscopie RMN
- Biomimetică: studiul efectului antibacterian al suprafețelor micropatternate și identificarea de soluții tehnologice care să mimeze suprafețele naturale
- Interacțiunea nanomateriale-celule: studii de biocompatibilitate și citotoxicitate a (nano)materialelor dedicate aplicațiilor medicale, biotehnologice și de mediu
Expertiză
- Obținerea de noi forme solide și de complecși de incluziune pentru molecule bioactive de interes în industria farmaceutică și a suplimenelor alimentare
- Metode de patternare a suprafețelor: NIL – Nanoimprint Lithography
- Extracție și purificare de complexe proteice macromoleculare solubile și membranare
- Analize de bicompatibiliate și citotoxicitate, imunochimie și analiză ultrastructurală a probelor biologice
- Spectroscopie RMN: lichide, solide
- Difracție de raze X: monocristale, pulberi
- Cristalografie RMN
- Microscopie electronică: SEM, TEM, HR-TEM, SAED-TEM
- Analize elementale: EDX, EBSD
- Microscopie de forță atomică: AFM
- Tehnici de analiză termică: DSC, ITC, tehnici fototermice, termografie activă
- Spectroscopie vibrațională: FT-IR, Raman, VCD
- Modelare moleculară: calcule de tip ab initio, DFT – density functional theory și mecanică moleculară pe sisteme restrânse și extinse (rețea cristalină)
- Modelare de fenomene complexe: simularea propagării căldurii în sisteme multistrat
Lider de Echipă
Dr. Xenia FILIP – Cercetător Științific II
Domeniu de expertiză: Spectroscopie RMN pe solide, Cristalografie RMN.
Membri:
Alin Alexandru ANDREI – Asistent Cercetător
Domeniu de expertiză:
Dr. Lucian BARBU – Cercetător Științific II
Domeniu de expertiză: Microscopie Electronică (TEM/SEM/EDX), Biologie Celulară.
Dr. Diana BOGDAN – Cercetător Științific II
Domeniu de expertiză: Microscopie de forță atomică, caracterizarea suprafețelor.
Marcel BOJAN – Tehnician
Dr. Gheorghe BORODI – Cercetător Științific I
Domeniu de expertiză: Difracție de raze X pe pulberi, Difracție de raze X pe monocristale, Împrăștierea razelor X la unghiuri mici, Fizica solidului.
Dr. Alexandra CIORÎȚĂ – Cercetător Științific III
Domeniu de expertiză: Biologie, Culturi celulare, Microscopie optică și electronică.
Gabriela Lenuța DAMIAN – Tehnician
Dr. Claudiu FILIP – Cercetător Științific I
Domeniu de expertiză: Spectroscopie RMN pe solide, Dinamică de spin – analitic și computațional, Cristalografie RMN.
Dr. Călin FLOARE – Cercetător Științific III
Domeniu de expertiză: Fizică atomică, moleculară și chimică, Chimie teoretică, Chimie fizică, Biotehnologie moleculară.
Dr. Ana Maria Raluca GHERMAN – Cercetător Științific III
Domeniu de expertiză: Fizică moleculară și chimică, Chimie computațională, Spectroscopie Raman, Analiză chemometrică multivariată, Docking moleculare.
Dr. Ioana GROSU – Cercetător Științific II
Domeniu de expertiză: sinteză de compuși organici, coordinativi şi polimeri; tehnici de cristalizare.
Dr. Irina KACSÓ – Cercetător Științific III
Domeniu de expertiză: Chimie organică, Analiză termică DSC, Spectroscopie FTIR.
Dr. ing. Flavia Adina MARTIN – Cercetător Științific II
Domeniu de expertiză: Sinteză de compuși organici, Sinteza iterativă de structuri dendritice, Forme solide / complecși de incluziune supramoleculari a substanțelor bioactive, Monostraturi auto-asamblate (SAM) pe suprafețe metalice.
Dr. Elena MATEI– Cercetător Științific II
Domeniu de expertiză: Spectroscopie RMN pe lichide, Biochimie/expresia şi purificarea proteinelor marcate izotopic, Cristalografie de raze X- proteine, Sinteza nanoparticulelor de aur/ screeningul lectinelor anti-virale.
Dr. Mihaela MIC – Cercetător Științific III
Domeniu de expertiză: Fizică atomică, moleculară și chimică, Chimie fizică.
Dr. Maria MICLĂUŞ – Cercetător Științific II
Domeniu de expertiză: Difracție de raze X, Difracție de raze X la unghiuri mic (SAXS), Screening de forme solide noi.
Dr. Augustin Cătălin MOŢ – Cercetător Științific II
Domeniu de expertiză: Chimie bioanalitică, Chemometrie, Biospectroscopie.
Dr. Adrian PÎRNĂU – Cercetător Științific II
Domeniu de expertiză: Fizică atomică, moleculară și chimică, Chimie teoretică, Chimie fizică.
Dr. Sebastian PORAV – Cercetător Științific III
Domeniu de expertiză: .
Dr. Cristian SEVCENCU – Cercetător Științific I
Domeniu de expertiză: .
Drd. Andrea SIMION – Asistent Cercetător
Domeniu de expertiză: Spectroscopie RMN pe solide.
Dr. Maria SUCIU – Cercetător Științific III
Domeniu de expertiză: Biologie celulară.
Ing. Septimiu TRIPON – Inginer Dezvoltare Tehnologică
Domeniu de expertiză: Microscopie electronică de transmisie și scanning, analize EDX, prepararea și procesarea tuturor tipurilor de probe de microscopie electronică.
Iulia Teodora VARGA-KOCSIS – Tehnician
Studii fundamentale privind structura și aderența polidopaminei (PDA)
Claudiu Filip, Jürgen Liebscher, Anca Petran, Diana Bogdan, Xenia Filip, Ioana Grosu, Monica Cîrcu, Andrea Simion, Ana-Maria Raluca Gherman
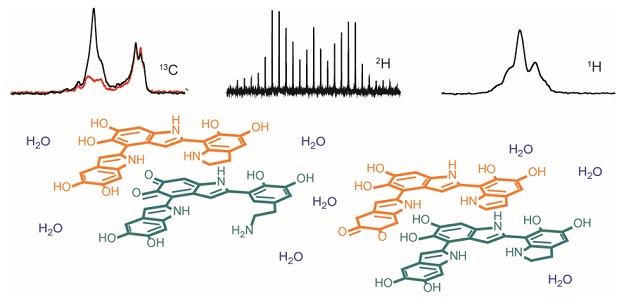 Până în prezent, atât structura exactă cât şi mecanismul de aderare atât de puternic al PDA la aproape orice substrat nu sunt pe deplin cunoscute. Grupul nostru a abordat această problemă prin efectuarea unor cercetări fundamentale la scară moleculară, atât a unor probe de tip “bulk” cât şi a unor probe sub formă de filme subţiri de PDA şi analogi ai PDA, folosind tehnica RMN în stare solidă pe probe cu abundenţă naturală sau marcate izotopic 13C/15N/2H , precum si prin AFM şi SEM/TEM pentru a corela rezultatele obţinute cu morfologia probelor. Aceste studii au fost efectuate în cadrul a două proiecte de cercetare1,2 și au generat o serie de rezultate remarcabile, printre care menționăm: (i) tipul cel mai probabil de conectivitate dintre unităţile structurale importante ale PDA3 şi analogi ai PDA4, (ii) dinamica moleculelor de apă în interiorul PDA3, (iii) corelația între condițiile de depunere, cum ar fi timpul, pH-ul, agentul oxidant și morfologia / grosimea stratului de acoperire PDA depus5, rolul lanțului lateral alifatic, inclusiv grupul amino, în aderența puternică a PDA la diferite tipuri de substrat6.
Până în prezent, atât structura exactă cât şi mecanismul de aderare atât de puternic al PDA la aproape orice substrat nu sunt pe deplin cunoscute. Grupul nostru a abordat această problemă prin efectuarea unor cercetări fundamentale la scară moleculară, atât a unor probe de tip “bulk” cât şi a unor probe sub formă de filme subţiri de PDA şi analogi ai PDA, folosind tehnica RMN în stare solidă pe probe cu abundenţă naturală sau marcate izotopic 13C/15N/2H , precum si prin AFM şi SEM/TEM pentru a corela rezultatele obţinute cu morfologia probelor. Aceste studii au fost efectuate în cadrul a două proiecte de cercetare1,2 și au generat o serie de rezultate remarcabile, printre care menționăm: (i) tipul cel mai probabil de conectivitate dintre unităţile structurale importante ale PDA3 şi analogi ai PDA4, (ii) dinamica moleculelor de apă în interiorul PDA3, (iii) corelația între condițiile de depunere, cum ar fi timpul, pH-ul, agentul oxidant și morfologia / grosimea stratului de acoperire PDA depus5, rolul lanțului lateral alifatic, inclusiv grupul amino, în aderența puternică a PDA la diferite tipuri de substrat6.
[1] PN3-P4-ID-PCE-2020-1463
[2] COFUND-M-ERANET-3-InsBIOration
[3] Closer to the polydopamine structure: new insights from a combined 13C/1H/2H solid-state NMR study on deuterated samples, M. Cîrcu, C. Filip, Polym. Chem. 9 (2018) 3379-3387
[4] Oxidative Polymerization of 3,4-Dihydroxybenzylamine – The Lower Homolog of Dopamine, A. Petran, C. Filip, D. Bogdan, C. Zimmerer, S. Beck, T. Radu, J. Liebscher, Langmuir 39 (2023) 5610; / Poly-2-aminomethyl-3-(3,4-dihydroxyphenyl)propionamide: From Structure to Proprieties, A. Petran, A.P. Crisan, C. Lar, A. Popa, T. Radu, A. Ciorata, D. Bogdan, M. Silion, C. Filip, ACS Appl. Polym. Mater. 5 (2023) 3370; / Novel Synthetic Dopamine Analogues: Carbon-13/Nitrogen-15 Isotopic Labeling and Fluorescence Properties, C. Lar, S. Radu, E. Gal, A. Falamas, J.Z. Szucs-Balazs, C. Filip, A. Petran, Anal. Lett. 56 (2023) 170
[5] How thick, uniform and smooth are the polydopamine coating layers obtained under different oxidation conditions? An in-depth AFM study, B. Diana, I.G. Grosu, C. Filip, Appl. Surf, Sci. 597 (2022) 153680
[6] Structural comparison between polydopamine precipitate and thin coating layers, down to nanometer film thicknesses, X. Filip, A. Simion, I.G. Grosu, A.M.R. Gherman, C. Lar, C. Filip, Appl. Surf. Sci. 649 (2023) 159190
Determinarea structurii cristaline a compușilor bioactivi prin cristalografie RMN
Claudiu Filip, Gheorghe Borodi, Xenia Filip, Maria Miclăuș, Ioana Grosu
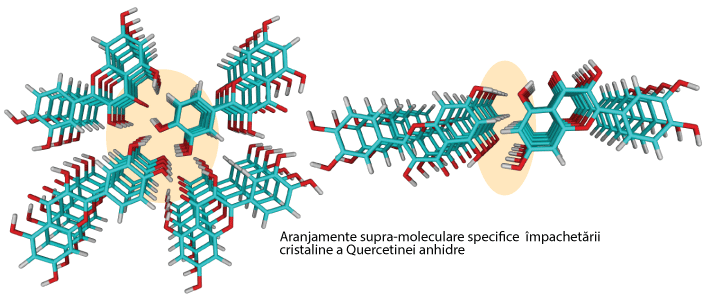
Cristalografia RMN a condus la îmbunătățiri semnificative ale metodologiei de caracterizare structurală a solidelor organice, în principal din pulberi microcristaline, prin combinarea spectroscopiei RMN pe solide, a difracției de raze X pe pulberi și a modelărilor moleculare în sisteme periodice extinse (cristale). Grupul nostru deține o experiență îndelungată[1] în acest domeniu și a adus contribuții importante, atât prin dezvoltări metodologice cât și prin aplicații practice. Ne-am focalizat în principal pe rezolvarea de probleme structurale complexe în compuși bioactivi, având în ultimii ani raportate peste 15 structuri cristaline pentru noi forme solide ale unor compuși precum Quercetină[2-5], Lisinopril[6,7], Ketoconazol[8-9[, Tadalafil[10] și Prometazină[11]. Între acestea, două dintre cazurile abordate trebuie subliniate în mod special: (i) Lisinopril dihidrat – un compus farmaceutic cu 24 grade de libertate ce trebuie rafinate, a cărui structură cristalină a fost determinată[6] din pulbere cu un nivel de precizie foarte apropiat de cel caracteristic difracției de raze X pe monocristal, și (ii) Quercetina anhidră – un compus bioactiv de origine naturală cu grupări hidroxil multiple, pentru care o abordare de tip cristalografie RMN s-a dovedit indispensabilă pentru a putea identifica în mod corect rețeaua de legături de hidrogen[5] care să conducă la împachetarea cristalină observată.
[1] Hydrogen-Mediated Noncovalent Interactions in Solids: What Can NMR Crystallography Tell About?, I.G. Grosu, X. Filip, M.O. Miclăuş, C. Filip, Molecules 25 (2020) 3757
[2] Optimized multi-step NMR-crystallography approach for structural characterization of a stable quercetin solvate, X. Filip, M. O. Miclăuș, F. Martin, C. Filip, I. G. Grosu, J. Pharm. Biomed. Anal. 138 (2017) 22-28
[3] Highly sensitive solid forms discrimination on the whole tablet of theactive ingredients in quercetin dietary supplements by NMR crystallography approaches, M. O. Miclăuș, X. Filip, C. Filip, F. A. Martin, I. G. Grosu, J. Pharm. Biomed. Anal. 124 (2016) 274–280
[4] Can the conformation of the flexible hydroxyl groups be constrained by simple NMR crystallography approaches? The case of quercetin solid forms, X. Filip, C. Filip, Solid State NMR 65 (2015) 21-28
[5] NMR crystallography methods to probe complex hydrogen bonding networks: application to structure elucidation of anhydrous quercetin, X. Filip, I. Grosu, M. Miclăuș, C. Filip, CrystEngComm 15 (2013) 4131-4142
[6] Optimizing structure determination from powders of crystalline organic solids with high molecular flexibility: the case of lisinopril dihydrate, M. Miclăuș, I. Grosu, X. Filip, C. Tripon, C. Filip, CrystEngComm 16 (2014) 299-303
[7] Testing the limits of sensitivity in a solid-state structural investigation by combined X-Ray Powder Diffraction, Solid-State NMR and molecular modelling, X. Filip, Gh. Borodi, C. Filip, Phys. Chem. Chem. Phys. 13 (2011) 17978-17986
[8] Ketoconazole-p-aminobenzoic Acid Cocrystal: Revival of an Old Drug by Crystal Engineering, F. Martin, M. Pop, I. Kacso, I.G. Grosu, M. Miclăuş, D. Vodnar, I. Lung, G.A. Filip, E.D. Olteanu, R. Moldovan, A. Nagy, X. Filip, I. Bâldea, Mol. Pharmaceutics, 17 (2020) 919-932
[9] Ketoconazole Salt and Co-crystals with Enhanced Aqueous Solubility, F.A. Martin, M.M. Pop, Gh. Borodi, X. Filip, I. Kacso, Crystal Growth&Design, 13 (2013) 4295-4304
[10] Crystal Structure and Desolvation Behaviour of the Tadalafil Monosolvates with Acetone and Methyl Ethyl Ketone, M. O. Miclăuș, I. E. Kacso, F. A. Martin, L. David, M.M. POP, C Filip, X. Filip, J. Pharm. Sci., 104 (2015) 3782–3788
[11] Distinct Disordered Forms of Promethazine Hydrochloride: A Case of lntergrowth of Polymorphic Domains?, G. Borodi, M.M. Pop, O. Onija, X. Filip, Crystal Growth&Design, 12 (2012) 5846-5851
Caracterizarea interacţiunilor intermoleculare dintre bioliganzi şi macromolecule
Adrian Pîrnău, Călin Gabriel Floare, Mihaela Mic, Mircea Bogdan
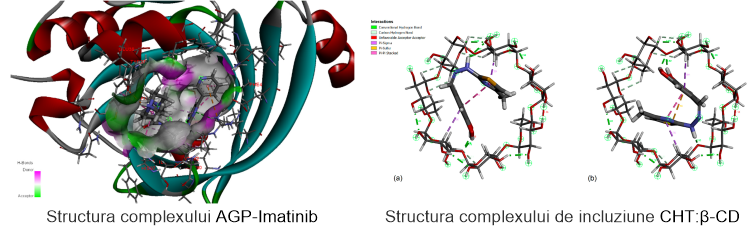
Preocupările actuale ale grupului nostru sunt direcţionate înspre înţelegerea mecanismelor de interacţie dintre bioliganzi şi macromolecule (proteine plasmatice, ciclodextrine) în stare lichidă, care să permită caracterizarea sistemelor moleculare în evoluţia lui dinamică, utilizând metode spectroscopice 1H RMN şi calorimetrice (ITC), precum şi metode de calcul ab initio şi simulări de dinamică moleculară.
Din punct de vedere biochimic şi clinic, studiul interacţiunii dintre medicamente şi proteine este o problemă importantă. Transportul medicamentelor în organism are loc prin intermediul sistemului circulator. Proteinele plasmatice prezintă abilitatea de a lega şi transporta o gamă largă de medicamente, metaboliți şi compuşi organici. Utilizând metode complementare am determinat stoichiometria şi constanta de asociere, dintre imatinib (un inhibitor selectiv al tirozin kinazei) şi α-1 glycoproteină (AGP), parametrii esențiali care indică afinitatea de legare a medicamentului de proteină[1]. De asemenea şi ciclodextrinele sunt utilizate ca transportori de medicamente în vedera optimizării eliberării controlate a acestora. Astfel caracterizarea complexului de incluziune β-cyclodextrină (β-CD) cu un derivat de catecol hidrazinil-tiazol (CHT) s-a realizat în soluţie[2].
[1] Study of the binding affinity between imatinib and α-1 glycoprotein using nuclear spin relaxation and isothermal titration calorimetry, Mihaela Mic, Adrian Pîrnău*, Călin G. Floare, Mircea Bogdan, International Journal of Biological Macromolecules 147 (2020) 326–332
[2] Inclusion of a Catechol-Derived Hydrazinyl-Thiazole (CHT) in β-Cyclodextrin Nanocavity and Its Effect on Antioxidant Activity: A Calorimetric, Spectroscopic and Molecular Docking Approach, Mihaela Mic, Adrian Pîrnău*, Călin G. Floare, Mariana Doina Palage, Ovidiu Oniga, Gabriel Marc, Antioxidants 12 (2023) 1367
Dezvoltări metodologice în spectroscopia RMN pe solide
Andrea Simion, Claudiu Filip
În colaborare cu Matthias Ernst (ETH Zürich, Elveția), Anne Lesage și Guido Pintacuda (High Field NMR Center, CNRS, Lyon, Franța), Gianluigi Veglia (Universitatea Minnesota, SUA)
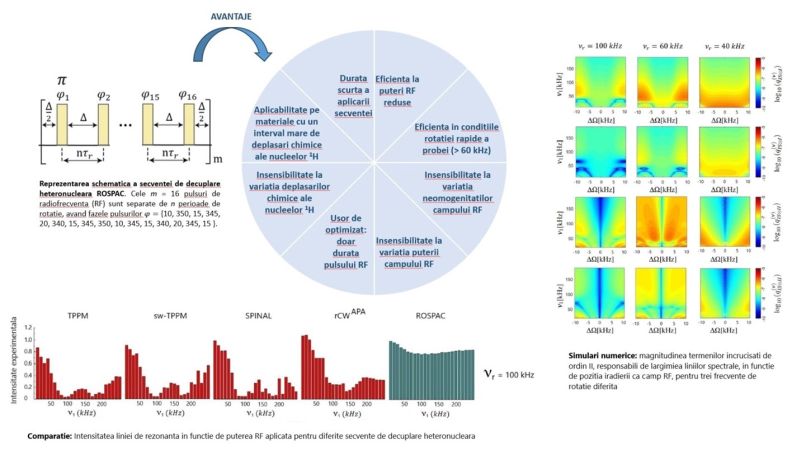
În spectroscopia RMN pe solide realizată la viteze de rotaţie mari (> 60 kHz), folosind secvențele de decuplare heteronucleare actuale, sunt dificil de obţinut rezoluţii spectrale mari şi sensibilitate. Principalele dezavantaje ale acestor secvenţe constă în imposibilitatea de a obţine: (i) rezultate similare pentru un interval mare de deplasări chimice în condiţii de iradiere cu putere de radiofrecvență (RF) redusă, (ii) independență față de puterea RF și (iii) insensibilitate la neomogenitățile câmpului RF.
Am dezvoltat o secvență nouă de pulsuri de decuplare heteronucleară pentru spectroscopia RMN pe solide în condiţii de rotaţie la viteze mari, care depășește aceste neajusuri, denumită Rotor-Synchronized Phase-Alternated Cycles (ROSPAC) [1,2]. Avantajele acesteia au fost ilustrate atât prin experimente reprezentative RMN în stare solidă cât și prin rezultate teoretice obținute printr-o abordare teoretică generalizată bazată pe teoria Floquet.
Pentru îmbunătăţirea în continuare a eficienţei secvenţelor de decuplare heteronucleară ne propunem proiectarea de pulsuri RF optimizate folosind inteligenţa artificială (AI).
[1] Heteronuclear decoupling with rotor-synchronized phase-alternated cycles, A. Simion, T. Schubeis, T. Le Marchand, M. Vasilescu, G. Pintacuda, A. Lesage, C. Filip, J. Chem. Phys. 157 (2022) 014202
[2] The effect of 1H offset and flip-angle on heteronuclear decoupling efficiency in ROSPAC pulsed sequence: A Floquet description, A. Simion, M. Ernst, C. Filip, J. Chem. Phys. 158 (2023) 154113
Obținerea formelor solide ale compușilor bioactivi prin cristalizare high-throughput
Irina Kacsó, Ioana Grosu, Flavia Martin, Maria Miclăuș, Gheorghe Borodi, Augustin Moţ
Colaborare cu grupul Conf. Dr. Ioana Baldea, Universitatea de Medicină și Farmacie Iuliu Hațieganu din Cluj-Napoca

Dezvoltarea unui medicament sau a unui supliment alimentar este un proces complex, costisitor şi de lungă durată, în cadrul căruia optimizarea formei solide a ingredientului activ reprezintă o etapă importantă. Forma solidă selectată influenţează în mod direct proprietăţile esenţiale ale unui compus bioactiv: solubilitatea, stabilitatea, biodisponibilitatea. Din acest motiv, screening-ul de noi forme solide (polimorfi, săruri, cocristale, hidraţi/solvaţi) este un proces important în dezvoltarea produsului final.
Screening-ul de forme solide noi cu tehnici de cristalizare în regim high-throughput (paralel) oferă posibilitatea aplicării unei game variate de metode de cristalizare, asigurând diversitatea experimentală necesară. Astfel, crește mult probabilitatea obținerii de forme solide stabile.
Expertiza grupului de cercetare a condus la obținerea şi caracterizarea formelor solide noi pentru diferite clase de compuşi farmaceutic activi[1,2], unele dintre acestea având stabilitate și solubilitate îmbunătățită față de ingredientul activ disponibil pe piață. Un astfel de exemplu este Ketoconazolul (KTZ): în urma unui studiu sistematic de inginerie cristalină efectuat în vederea îmbunătăţirii solubilităţii acestuia, s-au obţinut rezultate spectaculoase în cazul unei serii de sisteme cristaline binare cu acizi dicarboxilici. Dintre acestea, sarea cu acidul oxalic şi cocristalele cu acid fumaric, respectiv acid adipic au o solubilitate de 50 de ori, respectiv de peste 100 de ori mai mare decât KTZ[3,4].
În vederea evaluării potenţialului de piaţă al formelor solide având caracteristici îmbunătăţite (cocristale ale KTZ cu acid fumaric sau acid p-aminobenzoic, complex supramolecular a KTZ cu dendrimerul PAMAM-G5-NH2[5]), sunt esenţiale: i) studiul compatibilităţii şi stabilităţii cu excipienţi[6], etapă importantă în preformularea medicamentelor; ii) testarea biocompatibilităţii in vivo pe model animal pentru determinarea parametrilor clinici, hematologici, biochimici şi histologici[7,8] şi iii) determinarea profilului farmacocinetic pentru evidenţierea îmbunătăţirii biodisponibilităţii orale a formelor solide noi obţinute[7]. Testele in vivo au fost realizate la UMF Cluj.
[1] Structural studies of various olmesartan solvates, I. Grosu, F. Martin, A. Turza, M. Miclaus, I. Kacso, G. Borodi, Acta crystallographica – Section C 78 (2022) 240–249
[2] Exploring the polymorphism of selective androgen receptor modulator YK11, A. Turza, G. Borodi, M. Miclaus, M. Muresan-Pop, Journal of Molecular Structure, 1273 (2023), 134281
[3] Ketoconazole Salt and Co-crystals with Enhanced Aqueous Solubility, Flavia A.Martin, Mihaela M. Pop, Gheorghe Borodi, Xenia Filip, Irina Kacsó, Cryst. Growth Des. 13 (2013) 4295–4304
[4] Cerere Brevet OSIM nr. A/00408 din 15.07.2021, F. Martin, I. Kacso, X. Filip, I. Grosu, M. Pop, “Cocristal Ketoconazol – Acid Adipic 1:1 cu solubilitate crescută pentru administrare orală”
[5] Cerere Brevet OSIM nr. A/00385 din 2.07.2023, F. Martin, I. Baldea, M. Miclaus, I. Grosu, I. Kacso, A. Moț, “Complex supramolecular Ketoconazol-PAMAM-G5-NH2 pentru administrare topică”
[6] Solid-state compatibility studies of Ketoconazole-Fumaric acid co-crystal with tablet excipients, I. Kacso, L. M. Rus, F. Martin, M. Miclaus, X. Filip, M. Dan, J. Therm. Anal. Calorim. 143 (2021) 3499–3506
[7] Ketoconazole-p-aminobenzoic Acid Cocrystal: Revival of an Old Drug by Crystal Engineering, F. Martin, M. Pop, I. Kacso, I. Grosu, M. Miclaus, D. Vodnar, I. Lung, G.A. Filip, E.D. Olteanu, R. Moldovan, A. Nagy, X. Filip, I. Baldea, Mol. Pharmaceutics 17 (2020) 919–932
[8] Ketoconazole-p aminobenzoic cocrystal, an improved antimycotic drug formulation, does not induce skin sensitization on the skin of BALBc mice”, S. Danescu, G. A. Filip, R. Moldovan, D. Olteanu, A. Nagy, X. Filip, F. Martin, I. Kacso, I. Baldea, Inflammopharmacology 29 (2021) 3721–733
Marcarea izotopică a γD-cristalinului şi caracterizarea lui folosind spectroscopia RMN pe lichide
Elena Matei, Călin Gabriel Floare, Adrian Pîrnău, Mihaela Mic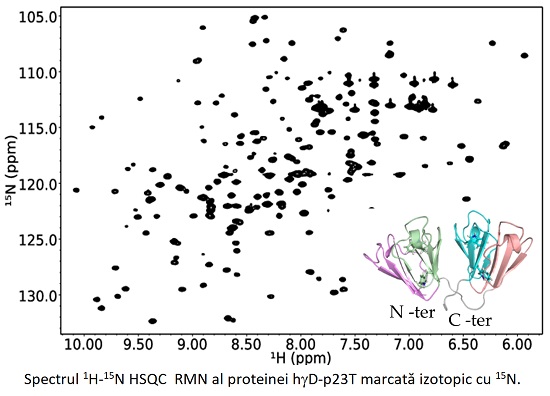
Proteinele structurale predominante din compoziţia lentilei oculare, denumite α, β, γ -cristalin, contribuie major la indicele optim de refracție necesar pentru a focaliza corect lumina pe retină. Pentru a-și indeplini funcția, proteinele cristalin trebuie să rămână stabile și solubile la concentrații foarte mari (~400 mg/ml) pe durata întregii viați. Din păcate, odată cu înaintarea în vârstă, sau din cauza unor factori congenitali, proteinele α, β, γ -cristalin, se degradează şi formează agregate care împrăștie lumina, acest fenomen stând la baza formării cataractei.
În încercarea de a studia la nivel molecular şi de a identifica un remediu neinvaziv pentru cataractă, efectuăm o cercetare extinsă folosind spectroscopia RMN pe lichide, şi un screening in silico al unei serii de potenţiali inhibitori naturali ai agregării. Efortul principal inițial în acest studiu a fost dedicat exprimării prin metoda recombinantă, și purificării proteinelor γD-cristalin umane marcate izotopic cu 15N, în varianta nativă (hγD-WT), și cea care prezintă o mutație de la Prolină la Treonină în poziția 23 (hγD-P23T) a lanţului polipeptidic, identificată ca fiind cauza dezvoltării cataractei congenitale. În mod adiţional, proteina însoţitoare de tip șoc termic αB-crystalin (αB-crys), cunoscută a ajuta la menţinerea echilibrului supramolecular în interiorul cristalinului a fost, de asemenea, exprimată şi purificată. Pentru expresia proteinelor, ADN-ul sintetic care codifică proteina nativă (hγD-WT), mutantul hγD-p23T, și αB-crys, a fost inserat în mod individual în vectorul de expresie pET-14b, urmând sa fie transformate în celulele de expresie nepatogene BL21(DE3).
În paralel, au fost efectuate simulări de andocare moleculară în care am comparat 13 inhibitori naturali studiați în literatură cu lanosterolul, un ingredient prezent în produsele pentru ochi fără prescripție medicală pentru prevenirea cataractei. Actualmente, studiem interacțiunile intermoleculare și complexele macromoleculare dintre hγD-P23T și αB-crys, în absența sau prezența potenţialilor inhibitorilor naturali ai agregării, folosind o secvenţă de pulsuri 2D 1H-15N-HSQC cu presaturare, pentru suprimarea solventului.
Mulţumim grupului Prof. Dr. László-Csaba Bencze din cadrul Facultăţii de Chimie și Inginerie Chimică, UBB Cluj-Napoca, pentru suportul în expresia și purificarea proteinelor.
Un nou model experimental de testare a efectelor cardiace a unor molecule şi a capacității unor materiale neconvenționale de a înregistra şi induce activitate bioelectrică
Cristian Sevcencu, Alin-Alexandru Andrei

Modelul experimental se bazează pe identitatea dintre electrofiziologia miocardul ventricular al embrionului de găină şi cea a miocardului ventricular al mamiferelor şi omului1. Pornind de la această identitate, am dezvoltat un sistem de înregistrare simultană a potențialelor de acțiune monofazice (MAP) şi ECG din inima embrionară de găină care permite evaluarea efectului cardiotoxic sau cardioprotector al unor molecule în faze incipiente de dezvoltare ale acestora2. Acelaşi model poate fi folosit şi pentru evaluarea capacității unor materiale neconvenționale (de exemplu, hidrogeluri electroconductive) de a înregistra şi induce activitate bioelectrică. Modelul a fost testat cu succes în ambele direcții şi a intrat în rutina laboratorului de electrofiziologie. Avantajele acestui model în comparație cu cele clasice care utilizează mamifere ca animale de laborator sunt: i) prețul mic al embrionilor de găină şi posibilitatea de a utiliza un număr mare de embrioni (şi astfel de a culege un număr mare de date experimentale) într-o perioadă scurtă de timp; ii) uşurința utilizării modelului; iii) lipsa constrângerilor etice3 şi plierea modelului pe cerințele actuale în materie de etică în ceea ce priveşte utilizarea animalelor de laborator4.
[1] The Electrophysiological Organization of the Embryonic Chick Heart, Lieberman M, Paes de CA, Journal of General Physiology 1965; 49(2):351-363.
[2] Cracking the Egg: Potential of the Developing Chicken as a Model System for Nonclinical Safety Studies of Pharmaceuticals, Bjornstad S et al., The Journal of Pharmacology and Experimental Therapeutics 2015; 355(3):386-396.
[3] Nociception in Chicken Embryos, Part II: Embryonal Development of Electroencephalic Neuronal Activity In Ovo as a Prerequisite for Nociception, Kollmansperger S et al., Animals (Basel) 2023;13(18).
[4] The multifactorial role of the 3Rs in shifting the harm-benefit analysis in animal models of disease, Graham ML, Prescott MJ., European Journal of Pharmacology 2015; 759:19-29.
Dezvoltare de noi compuşi biologic activi
Adrian Pîrnău, Călin Gabriel Floare, Mihaela Mic
Colaborare cu grupul Prof. Ovidiu Oniga, Universitatea de Medicină și Farmacie Iuliu Hațieganu din Cluj-Napoca
Colaborarea cu grupul Prof. Ovidiu Oniga (UMF Cluj-Napoca), grup în care se dezvoltă noi compuși biologic activi a vizat în principal caracterizarea structurală a compușilor nou sintetizați precum și transportul lor în organism. Această colaborare durează de peste 15 ani, iar rezultatele obținute în urma acestei colaborări au fost valorificate prin multe publicații în reviste cotate ISI[1][2].
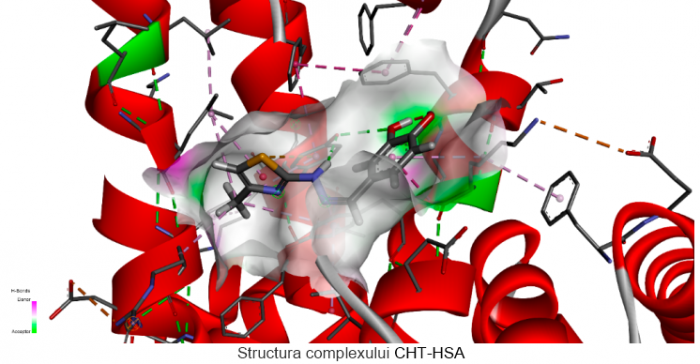
Polifenolii au atins o atenție pronunțată datorită capacității lor de a oferi numeroase beneficii pentru sănătate și prevenirea mai multor boli cronice. În acest studiu, a fost proiectată, sintetizată și caracterizată o moleculă nouă solubilă în apă care prezintă o bună activitate antioxidantă și anume catecol hidrazinil tiazol (CHT). Caracterizarea mecanismului de legare a CHT și HSA, principala proteină plasmatică ce prezintă abilitatea de a lega și transporta medicamente, s-a realizat prin metode experimentale (1H RMN si ITC) precum și calcule de andocare moleculară[3].
[1] Synthesis and anti-inflammatory evaluation of some new acyl-hydrazones bearing 2-aryl-thiazole, C. Moldovan, O. Oniga, A. Pârvu, B. Tiperciuc, P. Verite, A. Pîrnău, O. Crisan, M. Bojita, R.Pop, European Journal of Medicinal Chemistry, 46, 2 (2011) 526 – 534 – peste 100 de citări independente
[2] Discovery of A Novel Series of Quinazoline–Thiazole Hybrids as Potential Antiproliferative and Anti-Angiogenic Agents, A. Șandor, I. Fizeșan, I. Ionuț, G. Marc, C. Moldovan, I. Oniga, A. Pîrnău, L. Vlase, A.E. Petru, I. Macasoi, O. Oniga, Biomolecules, 14, 218 (2024) 1 – 31
[3] Antioxidant Activity Evaluation and Assessment of the Binding Affinity to HSA of a New Catechol Hydrazinyl-Thiazole Derivative, Mihaela Mic, Adrian Pîrnău*, Călin G. Floare, Raluca Borlan, Monica Focsan, Ovidiu Oniga, Mircea Bogdan, Laurian Vlase, Ilioara Oniga, Gabriel Marc, Antioxidants 11 (2022) 1245.
Senzori electrochimici
Diana Bogdan
Colaborare cu grupul Prof. Cecilia Cristea, Universitatea de Medicină și Farmacie Iuliu Hațieganu din Cluj-Napoca 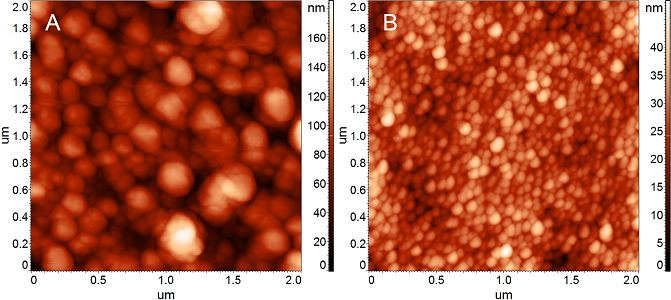
Senzorii electrochimici au înregistrat o creștere extraordinară în ultimul deceniu datorită progreselor în chimia materialelor și a celor din tehnologiile de comunicație digitală. În particular, electrozii modificați chimic au aplicații practice biomedicale în dezvoltarea unor dispozitive de analiză rapide, sensibile, selective, ușor de utilizat și noninvazive.
Colaborarea cu grupul Prof. Cecilia Cristea (UMF Cluj-Napoca), grup în care se dezvoltă astfel de senzori, a vizat în principal caracterizarea senzorilor electrochimici dezvoltați la UMF Cluj prin microscopie de forță atomică (AFM): senzori electrochimici pentru detecția dopaminei[1], senzori electrochimici pe bază de nanoparticule de polipirol (PPyNPs) decorate cu nanoparticule de aur (AuNPs) pentru detecția selectivă și senzitivă a serotoninei din probe reale de ser[2,7], aptasenzori impedimetrici pentru detecția selectivă a Interleukinei 6 (IL-6) cu utilitate în screeningul cancerului colorectal[3], senzor electrochimic pentru determinarea azitromicinei din probe biologice[4], aptasenzori pentru detectarea sensibilă și selectivă a lizozimei (Lyz)[5], aptasenzor pentru pentru determinarea on site a antibioticelor[6], aptasenzori pentru detectarea celulelor Jurkat T, celule tumorale în leucemia umană[8], aptasenzori pentru detectarea selectivă a gliadinei, componenta glutenului responsabilă de declanșarea bolii celiace[9] sau aptasenzori adaptați pentru detectarea specifică a tetraciclinei, pentru monitorizare in situ a apei[10].
[1] Mihaela Tertiș, Anca Florea, Alina Adumitrăchioaie, Andreea Cernat, Diana Bogdan, Lucian Barbu-Tudoran, Nicole Jaffrezic Renault, Robert Săndulescu, Cecilia Cristea: Detection of dopamine by a biomimetic electrochemical sensor based on polythioaniline bridged gold nanoparticles CHEMPLUSCHEM 82(4) 561-569 (2017)
[2] Mihaela Tertiș, Andreea Cernat, Daniela Lacatiș, Anca Florea, Diana Bogdan, Maria Suciu, Robert Săndulescu, Cecilia Cristea: Highly selective electrochemical detection of serotonin on polypyrrole and gold nanoparticles-based 3D architecture ELECTROCHEM COMMUN 75, 43-47 (2017)
[3] Mihaela Tertiș, Petrică Ionuț Leva, Diana Bogdan, Maria Suciu, Florin Graur, Cecilia Cristea: Impedimetric aptasensor for the label-free and selective detection of Interleukin-6 for colorectal cancer screening BIOSENS BIOELECTRON 137, 123-132 (2019)
[4] Ioan-Adrian Stoian, Bogdan-Cezar Iacob, Cosmina-Larisa Dudaș, Lucian Barbu-Tudoran, Diana Bogdan, Iuliu Ovidiu Marian, Ede Bodoki, Radu Oprean: Biomimetic electrochemical sensor for the highly selective detection of azithromycin in biological samples BIOSENS BIOELECTRON 155, 112098 (2020)
[5] Gheorghe Melinte, Oana Hosu, Geanina Ștefan, Diana Bogdan, Cecilia Cristea, Giovanna Marrazza: Poly-l-Lysine@gold nanostructured hybrid platform for lysozyme aptamer sandwich-based detection ELECTROCHIM ACTA 403, 139718 (2022)
[6] Adrian Blidar, Oana Hosu, Bogdan Feier, Geanina Ștefan, Diana Bogdan, Cecilia Cristea: Gold-based nanostructured platforms for oxytetracycline detection from milk by a “signal-on” aptasensing approach FOOD CHEM 371(3), 131127 (2022)
[7] Mihaela Tertiș, Petra Lia Sîrbu, Maria Suciu, Diana Bogdan, Ovidiu Pană, Cecilia Cristea, Ioan Simon: An innovative sensor based on chitosan and graphene oxide for selective and highly-sensitive detection of serotonin CHEMELECTROCHEM 9(6), e202101328 (2022)
[8] Iulia Rus, Mihaela Tertiș, Anca Pop, Ionel Fizeșan, Diana Bogdan, Elena Matei, Daniela Oprea, Victor Diculescu, Robert Săndulescu, Cecilia Cristea: The use of a new selective AB3 aptamer for the hematologic tumor cells’ detection SENSOR ACTUAT B-CHEM 394, 134389 (2023)
[9] Mihaela Tertiș, Manuela Zăgrean, Alexandra Pusta, Maria Suciu, Diana Bogdan, Cecilia Cristea: Innovative nanostructured aptasensor for electrochemical detection of gluten in food samples MICROCHEM J 193, 109069 (2023)
[10] Oana Hosu, George Melinte, Geanina Ștefan, Magdolna Casian, Cecilia Cristea: Towards selective tetracycline recognition in wastewater based on gold nanovoids@aptamer sensing ELECTROCHIM ACTA 460, 142556 (2023)
Investigarea prin RMN pe solide a sistemelor polimerice
Claudiu Filip, Xenia Filip
Colaborare cu Prof. Jürgen Liebscher, Dr. Alexandrina Nan și Dr. Anca Petran din cadrul echipei de cercetare Materiale multifuncționale și compuși biologic activi
Colaborare cu Radosław Mrówczyński, Centrul de Tehnologii Avansate al Universităţii Poznańskiego, Polonia
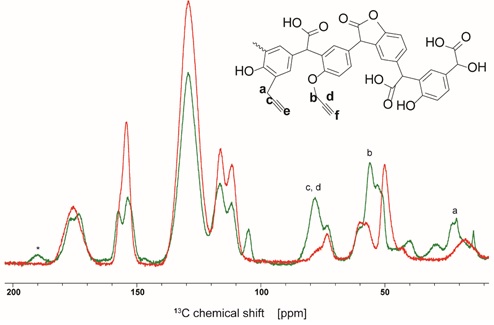
Cercetările din cadrul echipei Materiale multifuncționale și compuși biologic activi în domeniul materialelor polimerice și a compozitelor pe bază de polimeri vizează printre altele obținerea de noi polimeri / copolimeri, de preferinţă biocompatibili și biodegradabili, cu proprietăți adaptate pentru aplicații în industria farmaceutică, depoluare și medicină. Pentru a răspunde unor astfel de cerințe, este necesară o caracterizare cât mai detaliată a structurii și proprietăților fizico-chimice asociate noilor sisteme.
În contextul acestor cercetări, echipa noastră oferă întreaga expertiză în caracterizarea structurii materialelor polimerice prin spectroscopie RMN pe solide, contribuind de-a lungul timpului la o serie de rezultate remarcabile ale acestui grup de cercetare, dintre care amintim: determinarea unor caracteristici structurale ale polidopaminei[1], caracterizarea prin RMN pe solide ai unor analogi ai polidopaminei[2-4], și respectiv a unor noi polimeri biocompatibili / biodegradabili pe bază de acid tartaric[5], bezofuran-co- acid arylacetic[6] şi acid 4-fluoromandelic[7] sau copolimeri[8].
[1] Structure of polydopamine: a never-ending story?, J. Liebscher, R. Mrowczynski, S.A. Scheidt, C. Filip, N.D. Hădade, R. Turcu, A. Bende, S. Beck, Langmuir, 29 (2013) 10539-10548
[2] Replacing amine by azide: dopamine azide polymerization triggered by sodium periodate, M. Szukowska, Ł. Popenda, E. Coy, C. Filip, J. Grajewski, M. Kempiński, Y. Kim and R. Mrówczyński, Polymer Chemistry 13 (2022) 3325-3334
[3] Poly[3,4-dihydroxybenzhydrazide]: A Polydopamine Analogue?, A. Petran, N. D. Hădade, C. Filip, X. Filip, A. Bende, A. Popa, J. Liebscher, Macromolec. Chem. Phys. 219 (2018) 1700564
[4] Melanin-like polydopa amides – synthesis and application in functionalization of magnetic nanoparticles, A. Petran, R. Mrowczynski, C. Filip, R. Turcu, J. Liebscher, Polym. Chem. 6 (2015) 2139-2149
[5] Clean production of new functional coatings of magnetic nanoparticles from sustainable resources, A.Nan, X. Filip, M. Dan, O. Marincaş, J. Cleaner Prod. 210 (2019) 687-696
[6] Poly(benzofuran-co-arylacetic acid) – a new type of highly functionalized polymers, A. Nan, A. Bunge, M. Cîrcu, A. Petran, N.D. Hădade, X. Filip, Polym. Chem. 8 (2017) 3504-3514
[7] Efficient chemical synthesis of new thermoplastic fluorinated aromatic polyester, A. Nan, R. Teodora, X. Filip, I. Kacso, N.D. Hadade, F. Nekvapil, M. Miclăuş, Polymer 283 (2023) 126261
[8] Development of a New Eco-Friendly Copolymer Based on Chitosan for Enhanced Removal of Pb and Cd from Water, I.V. Ganea, A. Nan, C. Roba, I. Neamtiu, E. Gurzau, R. Turcu, X. Filip, C. Baciu, Polymers 14 (2022) 3735
Design, sinteză și caracterizare structurală de complecși supramoleculari formați prin legături de halogen
Ioana Grosu, Maria Miclăuș
Colaborare cu Grupul de Chimie Organică, Centrul de Chimie Supramoleculară Organică şi Organometalică – CCSOOM, Facultatea de Chimie și Inginerie Chimică, Universitatea Babeș-Bolyai
 Legăturile de halogen sunt unelte versatile pentru accesarea unor arhitecturi supramoleculare diverse, cum ar fi complecsi de tipul gazdă−oaspete, macrocicluri, criptanzi sau structuri polimerice 1D, 2D sau 3D. Datorită contribuției importante, cu direcționalitate și tărie similară legăturilor de hidrogen, a acestor interacțiuni la stabilizarea structurilor supramoleculare, legăturile de halogen sunt forțe motrice semnificative pentru auto-asamblarea supramoleculară, câștigând un mare interes în ultimele două decenii.
Legăturile de halogen sunt unelte versatile pentru accesarea unor arhitecturi supramoleculare diverse, cum ar fi complecsi de tipul gazdă−oaspete, macrocicluri, criptanzi sau structuri polimerice 1D, 2D sau 3D. Datorită contribuției importante, cu direcționalitate și tărie similară legăturilor de hidrogen, a acestor interacțiuni la stabilizarea structurilor supramoleculare, legăturile de halogen sunt forțe motrice semnificative pentru auto-asamblarea supramoleculară, câștigând un mare interes în ultimele două decenii.
În colaborare cu Grupul de Chimie Organică al Facultății de Chimie și Ingineri Chimică, UBB, s-au obținut și caracterizat structural sisteme polimerice supramoleculare cu arhitecturi diverse, formate prin interacțiuni de halogen N—I , X—X sau C(alifatic)–H—X (X: halogen).
[1] Halogen-bonded supramolecular architectures involving 2,7-dipyridylfluorene and 1,3,5-trifluoro-2,4,6-triiodobenzene tectons – a spectacular evolution from catemers to 2d halogen bond organic frameworks (XBOF), L. Cata, I.G. Grosu, M. Miclăuș, N.D. Hadade, I. Grosu, A. Terec, Studia Universitas Babeș-Bolyai Chemia, 67 (2022) 193
[2] Halogen-Bonded Organic Frameworks of Perfluoroiodo- and Perfluorodiiodobenzene with 2,2 ‘,7,7 ‘-Tetrapyridyl-9,9 ‘-spirobifluorene, L. Pop, I.G. Grosu, M. Miclăuș, N.D. Hadade, A. Pop, A. Bende, A. Terec, M. Barboiu, I. Grosu, Crystal Growth & Design, 21 (2021) 1045
[3] Halogen Bonds (N—I) at Work: Supramolecular Catemeric Architectures of 2,7-Dipyridylfluorene with ortho-, meta-, or para-Diiodotetrafluorobenzene Isomers, I.G. Grosu, L. Pop, M. Miclăuș, N.D. Hadade, A. Terec, A. Bende, C. Socaci, M. Barboiu, I. Grosu, Crystal Growth & Design, 20 (2020) 3429
[4] The nature of intermolecular interactions in pyridinium-anion-beta-hexachlorocyclohexane molecular crystals, I.G. Grosu, M.I. Rednic, M. Miclăuș, I. Grosu, A. Attila, Physical Chemistry Chemical Physics, 19 (2017) 20691
[5] Supramolecular anion recognition by beta-HCH, M.I. Rednic, R.A. Varga, A. Bende, I.G. Grosu, M. Miclăuș, N.D. Hadade, A. Terec, E. Bogdan, I. Grosu, Chemical Communications, 52 (2016) 12322
Sisteme supramoleculare pentru îmbunătățirea proprietăților fizico-chimice ai compușilor biologic activi naturali
Irina Kacsó, Flavia Martin, Maria Miclăuș, Xenia Filip, Călin Floare, Ioana Grosu, Alexandra Ciorîță, Sebastian Porav
Colaborare cu Parapharm SRL
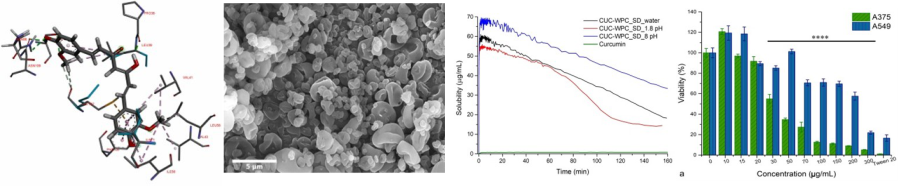
Valorificarea proprietăților terapeutice ale compușilor naturali este mult îngreunată de proprietățile fizico-chimice neavantajoase ale acestor substanțe: solubilitate apoasă, stabilitate și biodisponibilitate reduse. Îmbunătățirea acestor proprietăți fizico-chimice prin înglobarea compușilor în diferite matrici purtătoare este de importanță majoră atât pentru industria farmaceuticelor, cât și pentru cea a nutraceuticelor sau a dispozitivelor medicale.
Expertiza grupului în dezvoltarea sistemelor supramoleculare ai compușilor biologic activi naturali sau sintetici, utilizând matrici purtătoare oligo- sau polimerice de diferite tipuri a stat la baza colaborării cu Parapharm SRL – un jucător important pe piața suplimentelor alimentare.
Rezultatul acestei colaborări a condus la dezvoltarea unor sisteme supramoleculare Curcumină-Proteină din zer și caracterizarea fizico-chimică și biologică ale acestora.
[1] Curcumin and whey protein concentrate binding: Thermodynamic and structural approach, Cs-P Racz, L Zs Racz, C G Floare, G Tomoaia, O Horovitz, S Riga, I Kacso, G Borodi, M Sarkozi, A Mocanu, C Roman, M Tomoaia-Cotisel, Food Hydrocolloids 139 (2023) 108547
[2] Complexation of curcumin using whey proteins to enhance aqueous solubility, stability and antioxidant property, L ZS Racz, CS-P Racz, O Horovitz, G Tomoaia, A Mocanu, I Kacso, M Sarkozi, M Dan, S Porav, G Borodi, M Tomoaia-Cotisel, STUDIA UBB CHEMIA, LXVII, 3 (2022) 75-99
[3] Curcumin-whey protein solid dispersion system with improved solubility and cancer cell inhibitory effect, L ZS Racz, M Tomoaia-Cotisel, Cs-P Racz, P Bulieris, I Grosu, S Porav, A Ciorita, X Filip, F Martin, G Serban, I Kacso, STUDIA UBB CHEMIA, LXVI, 3 (2021) 209-224
