Echipa Tehnologii Moleculare și Biomoleculare este implicată în cercetări avansate care explorează și dezvoltă noi sisteme micro/nanostructurate destinate tehnologiilor emergente, aplicaţiilor teranostice biomedicale, biomimeticii, senzorilor moleculari și biomoleculari, electronicii moleculare etc.
Tematici iniţiate / dezvoltate
- Recunoaştere moleculară şi procese de auto-asociere, interacţiuni intra- şi inter-moleculare
- Structuri supramoleculare cu arhitectură şi funcţionalitate controlată
- Micro/nanostructuri inteligente bioinspirate cu aplicaţii în medicină, industrie şi anti-contrafacere
- Detecţia şi identificarea în timp real a microorganismelor prin tehnici spectroscopice ultrasenzitive
- Investigarea sistemelor moleculare depuse pe suprafeţe metalice, a proceselor de transport cuantic, respectiv a complecşilor biomoleculari prin tehnici „in silico”
- Identificarea de noi peptide antimicrobiene şi anticancerigene
- Mecanisme de transport prin membrane model, proteine, nanotuburi/nanopori biologici şi solid-state
- Dezvoltarea unor platforme inovative bazate pe exozomi destinate aplicaţiilor teranostice biomedicale
Expertiză
- Fabricarea structurilor moleculare cu arhitectură și funcționalitate controlată prin epitaxie cu fascicul molecular (MBE) în vid ultra-înalt și a suprafețelor micro/nano-structurate prin litografie de nanoimprint (NIL) cu aplicații în senzoristică și electronică moleculară
- Caracterizarea cu rezoluție nanometrică a topografiei suprafețelor utilizând tehnici microscopice de scanare (STM și AFM) în vid ultra-înalt
- Detecție de microorganisme prin spectroscopie Raman și Raman amplificată de suprafață (SERS) și discriminarea lor folosind analize chemometrice multivariate (PCA, LDA, PCA-LDA pe spectre vibraționale)
- Design raţional, generare şi caracterizare de peptide scurte antimicrobiene/anticancerigene
- Modelare moleculară multiscalară de la nivel atomic la nivel molecular (coarse-grained) şi simulare de sisteme biofizice complexe (proteine/peptide scurte, ADN/ARN, modele membranare bacteriene şi de mamifer) folosind dinamică moleculară, chimie cuantică
- Elaborare de modele „tight-binding” și modelare ab-initio pentru sisteme moleculare
- Calcul in silico a profilelor de energie libere/PMF de transport transmembranar, (auto) asociere, adeziune membranară prin metode la echilibru (Umbrella Sampling), neechilibru (FR method), flat-based histogram ((MW)2-XDOS method), andocare moleculară
- Caracterizare biomolecule (cu potenţial terapeutic/farmaceutice, biomimetice, proteinelor implicate în procese de semnalizare moleculară asociate cancerului, stresului oxidativ/bolilor neurodegenerative) prin metode computaţionale (simulări de dinamică moleculară, andocare moleculară); metode biochimice şi biofizice: SEC-MALS, tehnici spectroscopice (UV/Vis, fluorescenţă, Raman), imunodetecţie (Western Blot), tehnici de electroforeză şi densitometrie a gelurilor; metode biochimice şi microbiologice: activitate antibacteriană (MIC/MBC şi metoda difuzometrică), testare viabilitate celulară (IC50), activitate enzimatică (TTC), activitate metabolice (MTT), integritate membranară (LDH), activitate antioxidantă (SOD, CAT, GPx, GSH), markeri inflamatori
- Culturi celulare bacteriene; Expresie proteine in E. coli (clonare în vectori de expresie, PCR, mutageneză punctiformă, clonare prin asamblarea segmentelor de ADN); Purificare proteine (sonicare, centrifugare, tehnici cromatografice); Caracterizare structurală a proteinelor, moleculelor mici, biomoleculelor prin cristalografie cu raze X.
Lider de Echipă
Dr. Ioan TURCU – Cercetător principal (R4) – CS I
Domeniu de expertiză: Efectele câmpurilor electrice intense asupra celulelor biologice, Împrăștierea la unghiuri mici a radiației laser pe celulele biologice. Auto-asamblare a sistemelor supramoleculare, recunoaștere moleculară.
Membri:
Dr. Sanda BOCA-FARCĂU – Cercetător principal (R4) – CS I
Domeniu de expertiză: Nanoparticule și nanocompuși teranostici, (Micro)spectroscopie optică și vibrațională, Nanomedicină, Nanotoxicologie.
Dr. Ioana Andreea BREZESTEAN – Cercetător recunoscut (R2) – CS III
Domeniu de expertiză: Nanomateriale, Detecție de toxine, Raman, SERS, Microsopie, Caracterizarea materialelor, Uv-Vis, Sinteza de nanoparticule.
Dr. Paula BULIERIS – Cercetător recunoscut (R2) – CS III
Domeniu de expertiză:Biochimia Proteinelor, Biologie Structurală, Caracterizarea biomoleculelor prin tehnici biochimice și biofizic.
Dr. Alia COLNIŢĂ – Cercetător recunoscut (R2) – CS III
Domeniu de expertiză: Spectroscopie vibrațională, Chimie Fizică, Fizică biomoleculară.
Dr. Bogdan Ionuţ COZAR – Cercetător recunoscut (R2) – CS III
Domeniu de expertiză: Fizică moleculară și biomoleculară, Fizică teoretică.
Dr. Nicoleta DINA – Cercetător consacrat (R3) – CS II
Domeniu de expertiză: Spectroscopie vibrațională, Chimie analitică, Fizică biomoleculară, Fizică teoretică și statistică, Chemometrie, Modelare computațională.
Dr. Alexandra FĂRCAŞ – Cercetător debutant (R1) – CS
Domeniu de expertiză: .
Dr. Loránt JÁNOSI – Cercetător principal (R4) – CS I
Domeniu de expertiză: Modelare moleculară, Biofizică teoretică şi computaţională, Fizică atomică, moleculară și chimică, Chimie fizică.
Dr. Sorin Daniel MARCONI – Cercetător consacrat (R3) – CS II
Domeniu de expertiză: Fizica corpului solid, Nanomateriale, Filme subțiri, Fizică moleculară.
Dr. Anca-Daniela STOICA – Cercetător debutant (R1) – CS
Domeniu de expertiză: Biologie celulară și moleculară, Fiziologie animală, Biochimie, Hematologie.
Dr. Tiberiu SZŐKE-NAGY – Cercetător debutant (R1) – CS
Domeniu de expertiză: Biologie celulară și moleculară, Filogenie moleculară, Microbiologie generală.
Dr. Andra-Sorina TĂTAR – Cercetător recunoscut (R2) – CS III
Domeniu de expertiză: Sinteza de nanoparticule din metale nobile, Biocompatibilizare, Biofuncționalizare.
Design, fabrication and characterization of 3D micro-nano-structured hybrid (bio)materials using top down/bottom up techniques
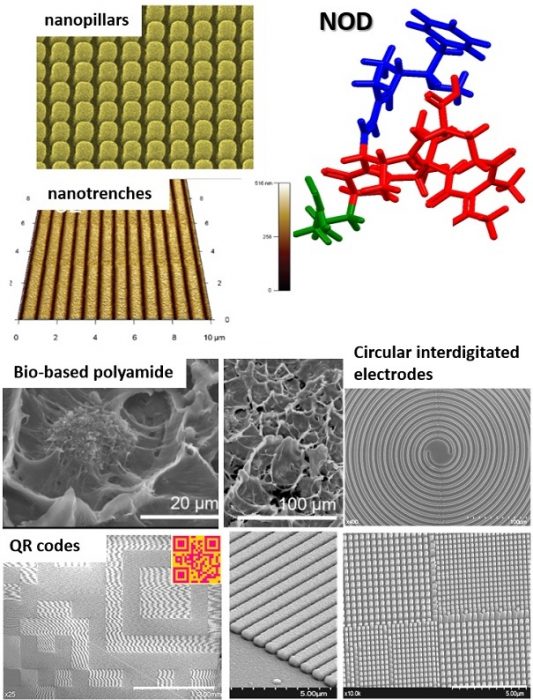
The design and fabrication of micro-nano-structured hybrid materials[1-2] that will later constitute support surfaces for detection based on ultrasensitive techniques such as drop-coating deposition Raman (DCDR) and surface-enhanced Raman spectroscopy (SERS) is our constant objective. The use of nanoimprint lithography (NIL) for the fabrication of nanotrenches or nanopillars in flexible and transparent thermoplastic was assessed. The morphological, optical and structural properties of the manufactured substrates were assessed by scanning electron microscopy (SEM), differential scanning analysis (DSC), finite-difference time-domain (FDTD) simulations and atomic force microscopy (AFM) techniques. For instance, a comprehensive Raman scattering-based characterization of a full bio-based polyamide loaded with graphene nanoplatelets or layered double hydroxides (LDH) was assessed for determining the conformational changes that take place in the nanocomposites[1]. Moreover, a difficult to detect cyanotoxin (nodularin – NOD)[3] was used for performing ultra-low SERS detection along with well-known Raman probe molecules by using colloidal silver nanoparticles (AgNPs), commercial nanopatterned substrates and in-house NIL-fabricated periodic nanotrenches covered by nanostructured silver (Ag) thin films. These studies reflected the most promising detection approaches, providing the lowest limits of detection. The specific figures of merit of such substrates and the overall enhancement factor was discused. As a result, anti-counterfeiting elements such as quick response (QR) codes meant to identify the authenticity/traceability of products[4], or flexible plasmonic sensing platforms[5] with great potential were obtained.
[1] “Scanning Electron Microscopy and Raman Spectroscopy Characterization of Structural Changes Induced by Thermal Treatment in Innovative Bio-Based Polyamide Nanocomposites” I.A. Brezeștean, D. Marconi, A. Colniță, A. Ciorîță, S.C. Tripon, Z. Vuluga, M.C. Corobea, N.E. Dina and I. Turcu, Chemosensors, 2023, 11, 28.
[2] “3D silver metallized nanotrenches fabricated by nanoimprint lithography as flexible SERS detection platform” A. Colniță, D. Marconi, N.E. Dina, I. A. Brezeștean, D. Bogdan, I. Turcu, Spec Acta A, 2022, 276, 121232.
[3] “Detection and Characterization of Nodularin by Using Label-Free Surface-Enhanced Spectroscopic Techniques” I.A. Brezeștean, A.M. Raluca Gherman, A. Colniță, N.E. Dina,C. Müller Molnár, D. Marconi, V. Chiș, I.L. David and Simona Cînta-Pînzaru, Int. J. Mol. Sci. 2022, 23, 15741.
[4] “High-Throughput Fabrication of Anti-Counterfeiting Nanopillar-Based Quick Response (QR) Codes Using Nanoimprint Lithography” A. Colniță, D. Marconi, I.A. Brezeștean, R.D. Pașca, I. Kacso, L. Barbu-Tudoran and Ioan Turcu, Analytical Letters, 2021, 54:1-2, 302-313.
[5] “Gold nanopost-shell arrays fabricated by nanoimprint lithography as a flexible plasmonic sensing platform” C. Farcău, D. Marconi, A. Colniță, I.A. Brezeștean and L. Barbu-Tudoran, Nanomaterials, 2019, 9(11), 1519.
Chemometric classification of pathogens at strain level based on SERS spectral fingerprinting
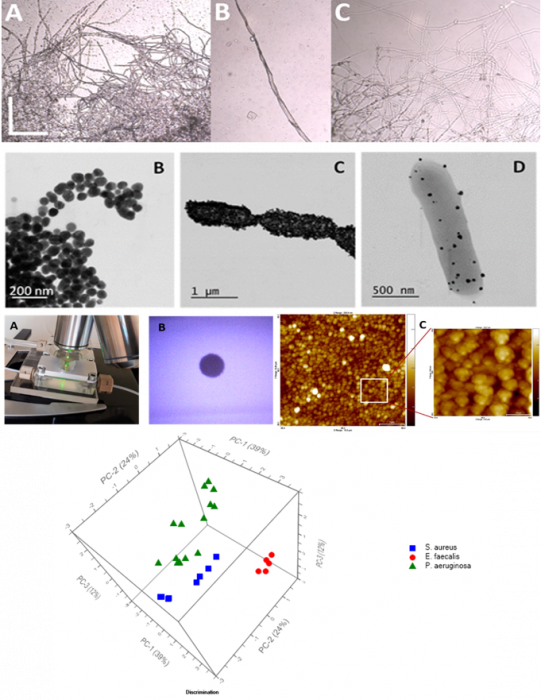
Advanced chemometric methods, such as fuzzy c-means, a semi-supervised clustering method, and fuzzy linear discriminant analysis (FLDA), a new robust supervised classification method in combination with principal component analysis (PCA), have been applied for classification of bacterial or fungal species detected at single-cell level by surface-enhanced Raman scattering (SERS) spectroscopy[1-3]. SERS spectra were recorded by using in situ synthesized silver nanoparticles or an in situ laser induced silver spot as metallic substrate. The detection process of bacteria was, in a particular study, isolated inside a hermetically sealed in-house built microfluidic device, connected to a syringe pump for injecting the analytes and a portable Raman spectrometer as detection tool[4]. These studies reflected the most promising detection approaches, providing single-cell limits of detection and the efficiency in bacteria characterization and classification based on SERS spectra[5].
[1] “Fuzzy characterization and classification of bacteria species detected at single-cell level by surface-enhanced Raman scattering” N.E. Dina, A.M. Raluca Gherman, A. Colniță, D. Marconi and C. Sârbu, Spec Acta A, 2021, 247, 119149.
[2] “Microfluidic Portable Device for Pathogens’ Rapid SERS Detection”, N.E. Dina, A. Colniță, D. Marconi, and A.M. Raluca Gherman, Proceedings, 2020, 60(1), 2.
[3] “Characterization of Clinically Relevant Fungi via SERS Fingerprinting Assisted by Novel Chemometric Models” N.E. Dina, A.M. Raluca Gherman, V. Chiş, C. Sârbu, A. Wieser, D. Bauer and C. Haisch, Analytical Chemistry, 2018, 90 (4), 2484-2492.
[4] Portable bacteria-capturing chip for direct surface-enhanced Raman scattering identification of urinary tractinfection pathogens” D. Yang , H. Zhou, N.E. Dina and C. Haisch, Royal Society Open Access, 2018, 5, 180955.
[5] “Rapid single-cell detection and identification of pathogens by using surface-enhanced Raman spectroscopy“ N.E. Dina, H. Zhou, A. Colniţă, N. Leopold, T. Szoke-Nagy, C. Coman, C. Haisch, Analyst, 2017, 142, 10, 1782-1789.
 Bio-inspired intelligent micro/nanostructures with applications in medicine, industry and anti-counterfeiting
Bio-inspired intelligent micro/nanostructures with applications in medicine, industry and anti-counterfeiting
The fabrication of well-defined nanostructures in various materials leads to different and unique properties compared to those of the bulk material, showing high promise in the development of very versatile biosensing platforms. Nanostructured surfaces are of particular interest in the field of medicine, especially in different domains of the healthcare sector: biosensing, drug delivery, biomaterials, implants therapeutics and medical devices and instruments. A particular case of nanostructuring is the formation of Si nanopillars, by using single-step fabrication of homoepitaxial silicon nanocones on Si(111) reconstructed substrates by molecular beam epitaxy technique. [1]. Another focal point deals with the effect of substrate temperature on structural and morphological properties of Au/Si(111) thin films with atomically flat gold terraces used as substrates for self assembled monolayers [2].
[1] A. Colniţă, D. Marconi, R. T. Brătfălean, I. Turcu, Applied Surface Science, Vol. 436, pp. 1163-1172 (2018)
[2] D. Marconi, A. Ungurean, Applied Surface Science, Vol. 288, pp. 166-171 (2014)
Discrimination and Characterization of Gram-Positive Bacteria by Means of Raman Spectroscopy and Principal Component Analysis
 Raman scattering and its particular effect, surface-enhanced Raman scattering (SERS), are whole-organism fingerprinting spectroscopic techniques that gain more and more popularity in bacterial detection. Two relevant Gram-positive bacteria species, Lactobacillus casei (L. casei) and Listeria monocytogenes (L. monocytogenes) were successfully discriminated based on the joint use of Raman, SERS and Principal Component Analysis (PCA) to their specific spectral data [1]. Furthermore, the biochemical structures of the bacterial cell wall of L. casei and L. monocytogenes were identified by using their Raman and SERS spectral fingerprints. Another recent result has materialized in a patent application submitted to OSIM: A00976/28.11.2018, authors: Dina Nicoleta Elena, Colniţă Alia, Marconi Sorin Daniel, Szöke-Nagy Tiberiu, Gherman Ana-Maria-Raluca, Leopold Nicolae, Ştefancu Andrei, title: Procedeu de detecție prin spectroscopie RAMAN amplificată de suprafață (SERS) într-un sistem de curgere microfluidic utilizând un spot de argint ca substrat amplificator SERS.
Raman scattering and its particular effect, surface-enhanced Raman scattering (SERS), are whole-organism fingerprinting spectroscopic techniques that gain more and more popularity in bacterial detection. Two relevant Gram-positive bacteria species, Lactobacillus casei (L. casei) and Listeria monocytogenes (L. monocytogenes) were successfully discriminated based on the joint use of Raman, SERS and Principal Component Analysis (PCA) to their specific spectral data [1]. Furthermore, the biochemical structures of the bacterial cell wall of L. casei and L. monocytogenes were identified by using their Raman and SERS spectral fingerprints. Another recent result has materialized in a patent application submitted to OSIM: A00976/28.11.2018, authors: Dina Nicoleta Elena, Colniţă Alia, Marconi Sorin Daniel, Szöke-Nagy Tiberiu, Gherman Ana-Maria-Raluca, Leopold Nicolae, Ştefancu Andrei, title: Procedeu de detecție prin spectroscopie RAMAN amplificată de suprafață (SERS) într-un sistem de curgere microfluidic utilizând un spot de argint ca substrat amplificator SERS.
Novel Antimicrobial Peptides
One of the main causes leading to antimicrobial (AM) resistance is the very slow progress in the development of new antibacterial drugs. The main challenge for discovering new AM peptides is increasing safety and efficacy of the novel drugs.
Using complementary computational and experimental techniques, we showed that the substitution of tryptophan by histidine in short tryptophan- and arginine-rich peptides proved to strongly modulate the antimicrobial activity, mainly by changing the peptide-to-membrane binding energy [1]. The substitution of arginine has low effect on the antimicrobial efficacy. The presence of histidine residue reduced the cytotoxic and hemolytic activity of the peptides. The peptides’ antimicrobial activity was correlated to the 3D-hydrophobic moment and to a simple structure-based packing parameter. Significance: The short tryptophan-rich peptides’ therapeutic index can be maximized using the histidine substitution to optimize their structure.
- Institute of Water Chemistry, Technische Universität München, GERMANY;
- BioNanoNet Association (BNN), Graz, AUSTRIA;
- National Institute for Biotechnology, Ben-Gurion University of the Negev, Be’er-Sheva, ISRAEL;
- Departamentul de Fizica Vieţii şi a Mediului, Institutul Național de Cercetare-Dezvoltare pentru Fizică și Inginerie Nucleară „Horia Hulubei” (IFIN-HH), București;
- Institutul de Cercetări Interdisciplinare în Bio-Nano-Științe, Universitatea Babeș-Bolyai, Cluj-Napoca;
- Universitatea de Medicină și Farmacie Iuliu Hațieganu Cluj- Napoca;
- Institutul de Cercetări Interdisciplinare (ICI) Universitatea Alexandru Ioan Cuza, Iași;
- Institutul Național de Cercetare-Dezvoltare pentru Chimie și Petrochimie – ICECHIM, București;
- Institutul National de Cercetare-Dezvoltare pentru Geologie și Geoecologie Marina GEOECOMAR, București;
- Institutul Național de Fizica Laserilor, Plasmei și Radiației (INFLPR), București;
- Centrul Internaţional de Biodinamică, București;
- Departamentul de Fizică, Universitate din Craiova.